Las ecuaciones de las reacciones complejas se aconseja ajustar por el método de ion electrón que es mucho más exacto, además es el más importante, de ahí que se dice que es el método más difundido para el logro deja igualación de ecuaciones iónicas redox es el método de ion-electrón (o de la semirreaccion).
Recursos para ajustar por este método.
Semirreacciones. Participan en ella un reductor y su oxidante.
Las semirreacciones pueden formularse en ambiente ácido generalmente a (H+) = 1, o bien, en ambiente alcalino a (OH-) = 1. El ajuste de las semireacciones comprende:
I. En solución acida.
a) El oxígeno perdido por un ion se combina con los iones H+ para formar H2O. Ejemplos:
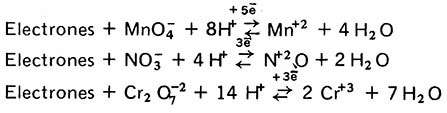
b) Cuando un ion adquiere átomos de oxígeno lo hace a expensas del H2O promoviendo la formación de iones H+. Ejemplos:
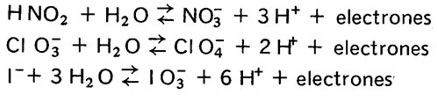
II. En solución básica.
a) El oxígeno perdido por un ion se combina con H2O para formar iones hidróxido. Ejemplos:

b) Cuando un ion adquiere átomos de oxígeno lo hace a expensas del ion OH– y promueve la formación de H2O, ejemplos:
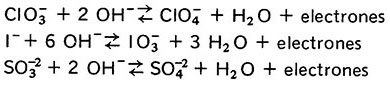
Ejercicios
Iguale las siguientes semirreacciones sin considerar por ahora, el número de electrones comprometidos.
Estas igualaciones de semirreacciones que implican ionesoxigenados es algo más laboriosa. Ejemplos:

La igualación de las semirreacciones es directa si ellas implican iones simples. Ejemplos:

El procedimiento más conveniente para ajustar estas ecuaciones de ión-electrón es desdoblar la ecuación en dos ecuaciones parciales completamente balanceadas o ajustadas.
Una muestra, la oxidación del reductor y la otra la reducción del oxidante. Luego estas dos ecuaciones parciales se suman para obtener la ecuación total o final. En este método no es necesario escribir los iones que no experimentan cambios de valencia, aunque puede hacerse si así se desea.
En la igualación de una ecuación por este método se distinguen algunas etapas o pasos necesarios que son:
1. Escribir la ecuación esquemática indicada.
2. Se escribe la semirreacción ubicando el número de oxidación sobre el elemento o radical correspondiente.
3. Se realiza la igualación atómica de cada semirreacción.
4. Se igualan eléctricamente los dos miembros de cada semirreacción agregando el número de electrones ganados o perdidos.
5. Se iguala el número de electrones comprometidos en las semirreacciones; para ello se multiplican ambas ecuaciones por los coeficientes que se han encontrado.
6. Se colocan estos coeficientes en, la ecuación indicada y así queda igualada o ajustada.
7. Para comprobar la ecuación molecular final se cuenta el número de átomos de oxígeno en ambos miembros de la ecuación, si coinciden la ecuación queda ajustada.
Nota. En la suma de semirreacciones se cancelan los términos (iones o moléculas) que aparecen repetidos a distinto lado y como es natural también se cancelan los electrones transferidos del reductor al oxidante.
Ejemplos:

Se colocan estos coeficientes en la ecuación indicada y así queda ajustada.
![]()
Ejercicios:
Se entregan a continuación otros ejemplos donde no se justifican los pasos seguidos, es el estudiante quien debe formular la justificación correspondiente. Ejemplos:



Nota. Obsérvese que hay sustancias que pueden actuar como oxidante o reductor Ejemplos: el agua, agua oxigenada, su comportamiento depende de la fuerza oxidante o reductora del sistema con que reacciona.
